Нитрит аммония - Ammonium nitrite
 | |
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.033.257 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
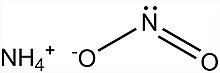
| NH4НЕТ2 | |
| Молярная масса | 64,04 г / моль |
| Внешность | бледно-желтые кристаллы, медленно разлагается на азот и воду |
| Плотность | 1,69 г / см3 |
| Температура плавления | Разлагается |
| 118,3 г / 100 мл | |
| Взрывоопасные данные | |
| Чувствительность к ударам | Низкий |
| Чувствительность к трению | Низкий |
| Скорость детонации | > 1000 м / с |
| Опасности | |
| Главный опасности | Взрывной |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Негорючий | |
| Родственные соединения | |
Другой анионы | Нитрат аммония |
Другой катионы | Нитрат натрия |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Нитрит аммония, NH4НЕТ2, это аммониевая соль из азотистая кислота. Он не используется в чистом изолированном виде, так как он очень нестабилен и разлагается на воды и азот, даже при комнатной температуре.
Подготовка
Нитрит аммония естественным образом образуется в воздухе и может быть получен путем поглощения равных частей диоксид азота и оксид азота в водной аммиак.[1]
Его также можно синтезировать путем окисления аммиака с озон или же пероксид водорода, или в осадки реакция нитрита бария или свинца с сульфат аммония, или нитрит серебра с хлорид аммония, или же перхлорат аммония с нитрит калия. Осадок отфильтровывают и раствор концентрируют. Образует бесцветные кристаллы, растворимые в воде.
Физические и химические свойства
Нитрит аммония может взорваться при температуре 60–70 ° C,[1] и разлагается быстрее при растворении в концентрированном водном растворе, чем в форме сухих кристаллов. Даже при комнатной температуре соединение разлагается на воду и азот;
Он разлагается при нагревании или в присутствии кислоты на воду и азот.[2] Раствор нитрита аммония стабилен при более высоком pH и более низкой температуре. Если произойдет снижение pH ниже 7,0, это может привести к взрыву, поскольку нитрит может на него отреагировать. Безопасный pH можно поддерживать, добавляя раствор аммиака. Мольное отношение нитрита аммония к аммиаку должно быть выше 10%.
Рекомендации
- ^ а б Томас Скотт; Мэри Иглсон (1994). Краткая энциклопедия химии. Вальтер де Грюйтер. п.66. ISBN 3-11-011451-8.
- ^ «Энциклопедия ВИАС: нитрит аммония».
| Этот неорганический сложный –Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |


